尽管CAR-T在急性B淋巴细胞白血病的治疗中显示出了卓越的疗效,但在实体瘤的治疗中,疗效并不如人意。其中缺乏合适的肿瘤靶点,是导致这一结果的重要原因之一。
理想的CAR-T靶点最好是肿瘤特异性抗原,也就是在肿瘤细胞表面独一无二的靶点,在这种情况下可以最大程度的保证CAR-T治疗的安全性。但事实上,绝大多数的肿瘤表面抗原在正常细胞上也有表达,只是肿瘤表面的抗原表达量更高一些。但这就带来了一个尴尬的结果:CAR-T细胞很可能无法识别哪一个是肿瘤细胞,哪一个是正常细胞,从而导致对正常细胞的攻击。这种现象被成为“On Target, Off Tumor”,严重时可能会导致患者的死亡。例如2016年美国曾开展的HER-2 CAR-T治疗结肠癌的治疗中,就有患者因为“On Target, off Tumor”导致肺功能衰竭死亡。
什么是TCR-T
正是应为肿瘤特异性抗原的缺乏,让人们将目光转移到了TCR-T技术上。但要了解TCR-T首先要了解一些略微复杂的免疫学概念:MHC(或者HLA)和T细胞受体(TCR)。MHC几乎表达在每个细胞表面,其作用是将细胞内蛋白抗原片段展现在细胞表面;而存在于细胞表面的TCR通过与HLA的结合判断靶细胞是否正常,如果T细胞发现其中有变异的蛋白片段,就会对靶细胞发起攻击,杀灭靶细胞。这意味着如果将可以识别某些特定肿瘤抗原的TCR表达在T细胞表面,就可以让这些TCR-T具备对肿瘤的杀伤能力。更重要的是由于TCR可以识别细胞内部的抗原,所以TCR-T技术在靶点的选择性上拥有巨大的优势。
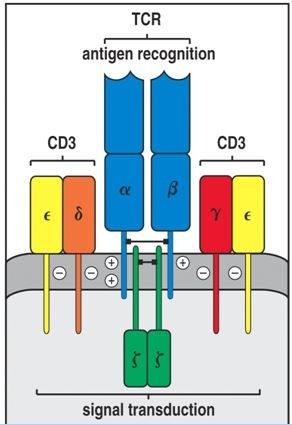
图示说明:TCR的结构
TCR-T的临床实验
NY-ESO-1是目前TCR-T治疗中效果最为显著的靶点,在由美国Memorial Sloan Kettering癌症中心主持的一项临床实验中,靶向NY-ESO-1的TCR-T在治疗滑膜肉瘤临床实验中显示出了较高的有效性和安全性。
| 分组 | NY-ES0-1表达情况 | 预处理方案 | 缓解率 |
|---|---|---|---|
| 1 | 高表达 | 氟达拉滨+环磷酰胺 | 50% |
| 2 | 低表达 | 氟达拉滨+环磷酰胺 | 33% |
| 3 | 高表达 | 环磷酰胺 | 20% |
| 4 | 高表达 | 氟达拉滨+低剂量环磷酰胺 | 36% |
除此之外,其他多个研究中心也开展了多个TCR-T相关的临床实验,尽管有效率不如靶向CD19CAR-T治疗急性B淋巴细胞白血病那么高,但仍证明其临床使用的潜在价值,但这些数据也表明TCR-T在临床使用中仍有诸多问题需要解决,诸如细胞因子风暴、TCR-T与其他组织的交叉反应。但总体而言,TCR-T的临床使用价值不容小觑,必将成为下一个肿瘤免疫治疗的爆发点
| 靶点 | 肿瘤 | 患者数 | 响应率 | 毒性 | 潜在毒性机制 |
|---|---|---|---|---|---|
| MART-1(DMF4)/HLA-A2 | 转移性黑色素瘤 | 17 | 12% | 无 | 无 |
| MART-1(DMF5)/HLA-A2 | 转移性黑色素瘤 | 20 | 30% | 3级皮肤毒性 3级听力毒性 3级视力毒性 |
皮肤、眼睛、内耳正常组织黑色素细胞交叉反应 |
| Gp100(154-162)/HLA-A2 | 转移性黑色素瘤 | 16 | 19% | 3级皮肤毒性 3级听力毒性 3级视力毒性 |
皮肤、眼睛、内耳正常组织黑色素细胞交叉反应 |
| CEA/HLA-A2 | 转移性结直肠癌 | 3 | 33% | 3级大肠炎 | 正常结直肠组织细胞交叉反应 |
| NY-ES0-1/HLA-A2 | 转移性黑色素瘤/滑液细胞瘤 | 20/18 | 55%/61 | 无 | 无 |
| NY-ES0-1/HLA-A2 | 多发性骨髓瘤 | 20 | 80% | 无 | 无 |
| MAGE-A3/HLA-A2 | 转移性黑色素瘤/滑液细胞瘤/食管癌 | 9 | 55% | 神经毒性和死亡 | 正常脑神经细胞交叉反应 |
| MAGE-A3/HLA-A1 | 转移性黑色素瘤/多发性骨髓瘤 | 2 | -- | 死亡 | 心肌组织Titin引起的交叉反应 |
| MAGE-A4/HLA-A24 | 食管癌 | 10 | 0% | 无 | 无 |